分子科学研究所
2014年度 成果事例
【目 的】
アルツハイマー病などの神経変性疾患の多くは、アミロイドと呼ばれる線維状凝集体が脳内に蓄積することにより、神経細胞の死滅を引き起こすことによると考えられている。これまでに、sorLA(ソーラ)という脳内のタンパク質が、アルツハイマー病の原因遺伝子産物であるアミロイドβペプチド(Aβ)を捕まえて分解系に送ることによりその蓄積を防ぐこと、すなわちsorLAが脳内で生じるAβペプチドを分解系へ運ぶ「掃除屋」のような役割を果たしている可能性を報告しているが、その構造基盤は明らかとなっていなかった。本研究では、高磁場NMR解析およびX線結晶構造解析により、sorLAがAβを捕捉している描像を原子レベルで解明することを目指した。
【成 果】
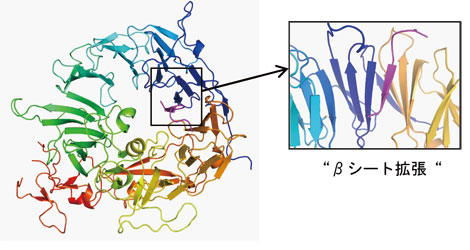
構造解析の結果、sorLAの細胞外領域のなかでもVps10pドメインと呼ばれる部分は、10枚の羽根をもつプロペラー様の形をしており、中央部には大きな空洞を有していることが判明した。そしてAβは、βシート拡張と呼ばれる生体内でアミロイドを形成するペプチドに特有の様式(クロスβ構造)で、この空洞の内側にへばりつくように結合していることが明らかとなった(図)[1]。この立体構造から、Aβがクロスβ構造をつくって毒性のあるアミロイドに変わるのを、sorLAは狭いトンネルに閉じ込めることで未然に防いでいるのではないかと考えらる。
アルツハイマー病の予防と治療のためには脳内Aβレベルを下げることが有効であるが、有望な薬はまだ開発されていない。今回の結果は、我々の体内にもともと存在するアルツハイマー病に対する防御因子の作用メカニズムを明らかにしたものとして注目される。脳内のsorLAの機能を賦活化することで、アルツハイマー病だけでなく、様々な神経変性疾患の発症リスクを低減することができる可能性がある。
[1] Y Kitago. et al., Nature Struct. Mol. Biol. 22, 199-206 (2015).